Salah satu pertanyaan penting dalam studi sistem termodinamika dalam fisika adalah pertanyaan apakah sistem ini dapat melakukan beberapa pekerjaan yang berguna. Berkaitan erat dengan konsep usaha adalah konsep energi dalam. Pada artikel ini, kita akan membahas apa itu energi internal gas ideal dan memberikan rumus untuk menghitungnya.
Gas ideal
Tentang gas, sebagai keadaan agregasi, yang tidak memiliki gaya elastis di bawah pengaruh eksternal padanya dan, sebagai akibatnya, tidak mempertahankan volume dan bentuk, setiap anak sekolah tahu. Konsep gas ideal bagi banyak orang tetap tidak dapat dipahami dan tidak jelas. Mari kita jelaskan.
Gas ideal adalah gas yang memenuhi dua kondisi penting berikut:
- Partikel penyusunnya tidak memiliki ukuran. Mereka memang memiliki ukuran, tetapi sangat kecil dibandingkan dengan jarak di antara mereka sehingga dapat diabaikan dalam semua perhitungan matematis.
- Partikel tidak berinteraksi satu sama lain menggunakan gaya atau gaya van der Waalsalam lainnya. Faktanya, dalam semua gas nyata, interaksi seperti itu ada, tetapi energinya dapat diabaikan dibandingkan dengan energi rata-rata partikel kinetik.
Kondisi yang dijelaskan dipenuhi oleh hampir semua gas nyata, yang suhunya di atas 300 K, dan tekanannya tidak melebihi satu atmosfer. Untuk tekanan yang terlalu tinggi dan suhu rendah, amati penyimpangan gas dari perilaku ideal. Dalam hal ini, seseorang berbicara tentang gas nyata. Mereka dijelaskan oleh persamaan van der Waals.
Konsep energi dalam gas ideal
Sesuai dengan definisi, energi dalam suatu sistem adalah jumlah energi kinetik dan energi potensial yang terkandung dalam sistem ini. Jika konsep ini diterapkan pada gas ideal, maka komponen potensial harus dibuang. Memang, karena partikel gas ideal tidak berinteraksi satu sama lain, mereka dapat dianggap bergerak bebas dalam ruang hampa mutlak. Untuk mengekstraksi satu partikel dari sistem yang sedang dipelajari, tidak perlu melakukan kerja melawan gaya interaksi internal, karena gaya-gaya ini tidak ada.
Dengan demikian, energi internal gas ideal selalu bertepatan dengan energi kinetiknya. Yang terakhir, pada gilirannya, secara unik ditentukan oleh massa molar partikel sistem, jumlahnya, serta kecepatan rata-rata gerakan translasi dan rotasi. Kecepatan gerakan tergantung pada suhu. Peningkatan suhu menyebabkan peningkatan energi internal, dan sebaliknya.
Rumus rumusenergi dalam
Menunjukkan energi dalam sistem gas ideal dengan huruf U. Menurut termodinamika, itu didefinisikan sebagai perbedaan antara entalpi H sistem dan produk tekanan dan volume, yaitu:
U=H - pV.
Pada paragraf di atas, kami menemukan bahwa nilai U sesuai dengan energi kinetik total Eksemua partikel gas:
U=Ek.
Dari mekanika statistik, dalam kerangka teori kinetik molekuler (MKT) gas ideal, maka energi kinetik rata-rata satu partikel Ek1 sama dengan nilai berikut:
Ek1=z/2kBT.
Di sini kB dan T - Konstanta Boltzmann dan suhu, z - jumlah derajat kebebasan. Energi kinetik total sistem Ek dapat diperoleh dengan mengalikan Ek1 dengan jumlah partikel N dalam sistem:
Ek=NEk1=z/2NkBT.
Dengan demikian, kita telah memperoleh rumus untuk energi internal gas ideal, yang ditulis dalam bentuk umum dalam bentuk suhu mutlak dan jumlah partikel dalam sistem tertutup:
U=z/2NkBT.
Gas monoatomik dan poliatomik
Rumus untuk U yang ditulis pada paragraf artikel sebelumnya tidak praktis untuk digunakan, karena sulit untuk menentukan jumlah partikel N. Namun, jika kita memperhitungkan definisi jumlah zat n, maka ekspresi ini dapat ditulis ulang dalam bentuk yang lebih nyaman:
n=T/TA; R=NAkB=8, 314 J/(molK);
U=z/2nR T.
Jumlah derajat kebebasan z bergantung pada geometri partikel yang menyusun gas. Jadi, untuk gas monoatomik, z=3, karena atom dapat bergerak secara bebas hanya dalam tiga arah ruang. Jika gas adalah diatomik, maka z=5, karena dua derajat kebebasan rotasi ditambahkan ke tiga derajat kebebasan translasi. Akhirnya, untuk gas poliatomik lainnya, z=6 (3 derajat kebebasan translasi dan 3 rotasi). Dengan mengingat hal ini, kita dapat menulis dalam bentuk berikut rumus untuk energi internal gas ideal monoatomik, diatomik dan poliatomik:
U1=3/2nRT;
U2=5/2nRT;
U≧3=3nRT.
Contoh tugas menentukan energi dalam
Sebuah silinder 100 liter berisi hidrogen murni pada tekanan 3 atmosfer. Dengan asumsi hidrogen menjadi gas ideal dalam kondisi tertentu, perlu untuk menentukan berapa energi internalnya.

Rumus U di atas mengandung jumlah zat dan suhu gas. Dalam kondisi masalah, sama sekali tidak ada yang dikatakan tentang jumlah ini. Untuk memecahkan masalah, perlu untuk mengingat persamaan Clapeyron-Mendeleev universal. Ini memiliki penampilan yang ditunjukkan pada gambar.
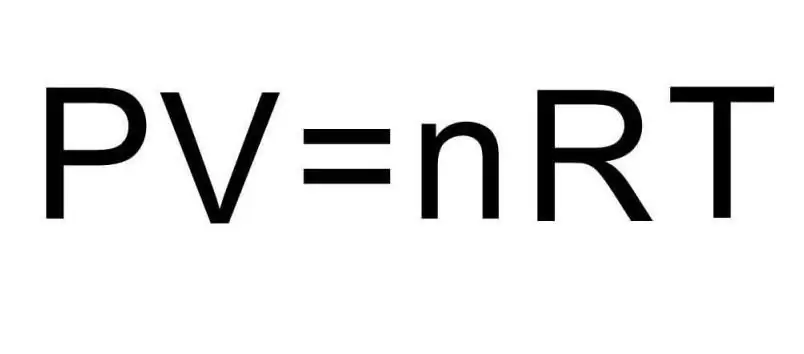
Karena hidrogen H2 adalah molekul diatomik, rumus energi dalam adalah:
UH2=5/2nRT.
Membandingkan kedua ekspresi, kita sampai pada rumus akhir untuk menyelesaikan masalah:
UH2=5/2PV.
Tetap mengubah satuan tekanan dan volume dari kondisi ke sistem satuan SI, gantikan nilai yang sesuai dalam rumus untuk UH2dan dapatkan jawaban: UH2 ≈ 76 kJ.






