Mempelajari sifat-sifat gas ideal adalah topik penting dalam fisika. Pengenalan karakteristik sistem gas dimulai dengan pertimbangan persamaan Boyle-Mariotte, karena ini adalah hukum gas ideal yang pertama kali ditemukan secara eksperimental. Mari kita pertimbangkan lebih detail di artikel.
Apa yang dimaksud dengan gas ideal?
Sebelum berbicara tentang hukum Boyle-Mariotte dan persamaan yang menjelaskannya, mari kita definisikan gas ideal. Ini umumnya dipahami sebagai zat cair di mana partikel-partikel yang menyusunnya tidak berinteraksi satu sama lain, dan ukurannya sangat kecil dibandingkan dengan jarak antar partikel rata-rata.
Sebenarnya, setiap gas adalah nyata, yaitu atom dan molekul penyusunnya memiliki ukuran tertentu dan tidak berinteraksi satu sama lain dengan bantuan gaya van der Waals. Namun, pada suhu absolut tinggi (lebih dari 300 K) dan tekanan rendah (kurang dari satu atmosfer), energi kinetik atom dan molekul jauh lebih tinggi daripada energi interaksi van der Waals, sehingga gas nyata padakondisi dengan akurasi tinggi dapat dianggap ideal.
Persamaan Boyle-Mariotte
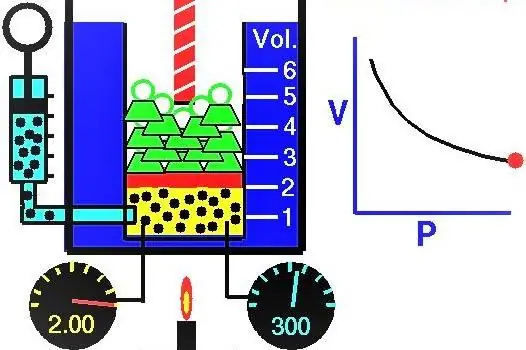
Sifat gas Ilmuwan Eropa aktif dieksplorasi selama abad XVII-XIX. Hukum gas pertama yang ditemukan secara eksperimental adalah hukum yang menjelaskan proses isotermal dari ekspansi dan kompresi sistem gas. Eksperimen yang sesuai dilakukan oleh Robert Boyle pada tahun 1662 dan Edm Mariotte pada tahun 1676. Masing-masing ilmuwan ini secara independen menunjukkan bahwa selama proses isotermal dalam sistem gas tertutup, tekanan berubah berbanding terbalik dengan volume. Ekspresi matematis yang diperoleh secara eksperimental dari proses ini ditulis dalam bentuk berikut:
PV=k
Di mana P dan V adalah tekanan dalam sistem dan volumenya, k adalah suatu konstanta, yang nilainya tergantung pada jumlah zat gas dan suhunya. Jika Anda membangun ketergantungan fungsi P(V) pada grafik, maka itu akan menjadi hiperbola. Contoh kurva ini ditunjukkan di bawah ini.
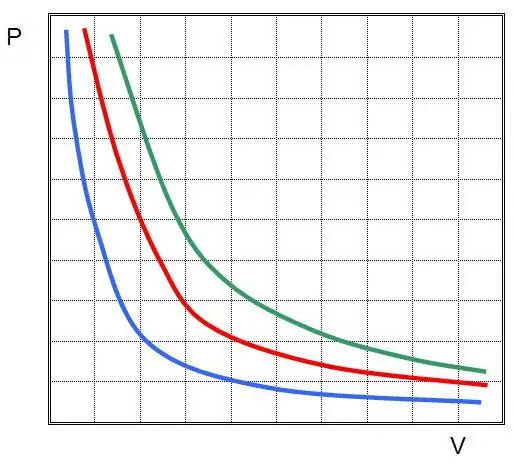
Persamaan tertulis disebut persamaan (hukum) Boyle-Mariotte. Hukum ini dapat dirumuskan secara singkat sebagai berikut: pemuaian gas ideal pada suhu konstan menyebabkan penurunan tekanan yang proporsional di dalamnya, sebaliknya, kompresi isotermal sistem gas disertai dengan peningkatan tekanan yang proporsional di dalamnya.
Persamaan gas ideal
Hukum Boyle-Mariotte adalah kasus khusus dari hukum yang lebih umum yang menyandang nama Mendeleev danClapeyron. Emile Clapeyron, meringkas informasi eksperimental tentang perilaku gas di bawah berbagai kondisi eksternal, pada tahun 1834 diperoleh persamaan berikut:
PV=nRT
Dengan kata lain, hasil kali volume V sistem gas dan tekanan P di dalamnya berbanding lurus dengan produk suhu mutlak T dan jumlah zat n. Koefisien proporsionalitas ini dilambangkan dengan huruf R dan disebut konstanta universal gas. Dalam persamaan tertulis, nilai R muncul karena penggantian sejumlah konstanta, yang dibuat oleh Dmitry Ivanovich Mendeleev pada tahun 1874.
Dari persamaan keadaan universal mudah untuk melihat bahwa keteguhan suhu dan jumlah zat menjamin invarian dari sisi kanan persamaan, yang berarti bahwa sisi kiri persamaan juga akan tetap konstan. Dalam hal ini, kita mendapatkan persamaan Boyle-Mariotte.

Hukum gas lainnya
Persamaan Clapeyron-Mendeleev yang ditulis dalam paragraf di atas berisi tiga parameter termodinamika: P, V dan T. Jika masing-masing tetap, dan dua lainnya dibiarkan berubah, maka kita mendapatkan Boyle-Mariotte, persamaan Charles dan Gay-Lussac. Hukum Charles berbicara tentang proporsionalitas langsung antara volume dan suhu untuk proses isobarik, dan hukum Gay-Lussac menyatakan bahwa dalam kasus transisi isokhorik, tekanan gas meningkat atau menurun berbanding lurus dengan suhu absolut. Persamaan yang sesuai terlihat seperti ini:
V/T=const ketika P=const;
P/T=const ketika V=const.
JadiJadi, hukum Boyle-Mariotte adalah salah satu dari tiga hukum gas utama. Namun, ini berbeda dari yang lain dalam hal ketergantungan grafik: fungsi V(T) dan P(T) adalah garis lurus, fungsi P(V) adalah hiperbola.
Contoh tugas penerapan hukum Boyle-Mariotte
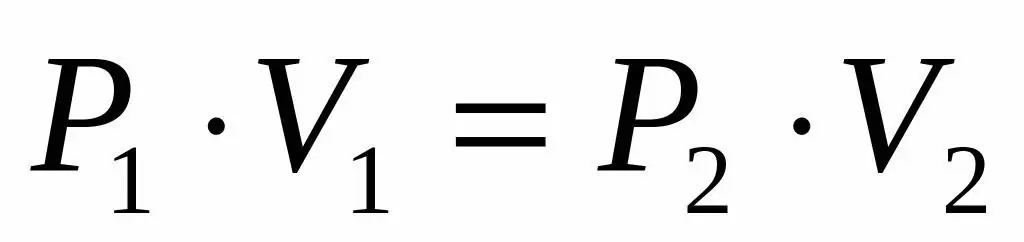
Volume gas dalam silinder di bawah piston pada posisi awal adalah 2 liter, dan tekanannya adalah 1 atmosfer. Berapakah tekanan gas setelah piston naik dan volume sistem gas bertambah 0,5 liter. Proses ini dianggap isotermal.
Karena kita diberi tekanan dan volume gas ideal, dan kita juga tahu bahwa suhu tetap tidak berubah selama pemuaian, kita dapat menggunakan persamaan Boyle-Mariotte dalam bentuk berikut:
P1V1=P2V 2
Kesamaan ini menyatakan bahwa hasil kali volume-tekanan adalah konstan untuk setiap keadaan gas pada suhu tertentu. Mengekspresikan nilai P2 dari persamaan, kita memperoleh rumus akhir:
P2=P1V1/V 2
Saat melakukan perhitungan tekanan, Anda dapat menggunakan unit di luar sistem dalam kasus ini, karena liter akan menyusut, dan kami mendapatkan tekanan P2dalam atmosfer. Mengganti data dari kondisi, kami sampai pada jawaban atas pertanyaan masalah: P2=0,8 atmosfer.






