Dalam termodinamika, ketika mempelajari transisi dari keadaan awal ke keadaan akhir suatu sistem, penting untuk mengetahui efek termal dari proses tersebut. Konsep kapasitas panas terkait erat dengan efek ini. Pada artikel ini, kita akan membahas pertanyaan tentang apa yang dimaksud dengan kapasitas kalor isokhorik suatu gas.
Gas ideal
Gas ideal adalah gas yang partikelnya dianggap sebagai titik material, yaitu, mereka tidak memiliki dimensi, tetapi memiliki massa, dan di mana semua energi internal hanya terdiri dari energi kinetik dari pergerakan molekul dan atom.
Setiap gas nyata idealnya tidak akan pernah memenuhi model yang dijelaskan, karena partikelnya masih memiliki beberapa dimensi linier dan berinteraksi satu sama lain menggunakan ikatan van der Waals yang lemah atau ikatan kimia jenis lain. Namun, pada tekanan rendah dan suhu tinggi, jarak antar molekul besar, dan energi kinetiknya melebihi energi potensial puluhan kali lipat. Semua ini memungkinkan untuk menerapkan dengan tingkat akurasi yang tinggi model ideal untuk gas nyata.
Energi dalam gas
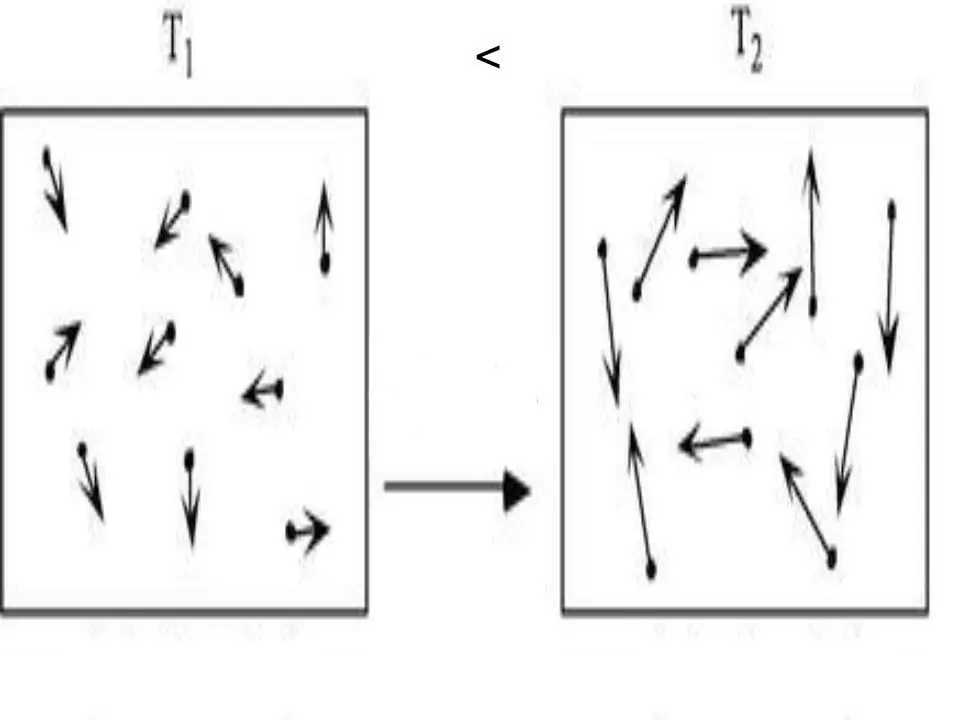
Energi internal sistem apa pun adalah karakteristik fisik, yang sama dengan jumlah energi potensial dan energi kinetik. Karena energi potensial dapat diabaikan dalam gas ideal, kita dapat menulis persamaannya:
U=Ek.
Di mana Ek adalah energi sistem kinetik. Dengan menggunakan teori kinetik molekuler dan menerapkan persamaan keadaan universal Clapeyron-Mendeleev, tidak sulit untuk mendapatkan ekspresi untuk U. Ditulis di bawah ini:
U=z/2nRT.
Di sini T, R dan n masing-masing adalah suhu mutlak, konstanta gas, dan jumlah zat. Nilai-z adalah bilangan bulat yang menunjukkan jumlah derajat kebebasan yang dimiliki molekul gas.
Kapasitas panas isobarik dan isokhorik
Dalam fisika, kapasitas kalor adalah jumlah kalor yang harus diberikan ke sistem yang dipelajari untuk memanaskannya sebesar satu kelvin. Definisi sebaliknya juga benar, yaitu, kapasitas panas adalah jumlah panas yang dilepaskan sistem ketika didinginkan oleh satu kelvin.
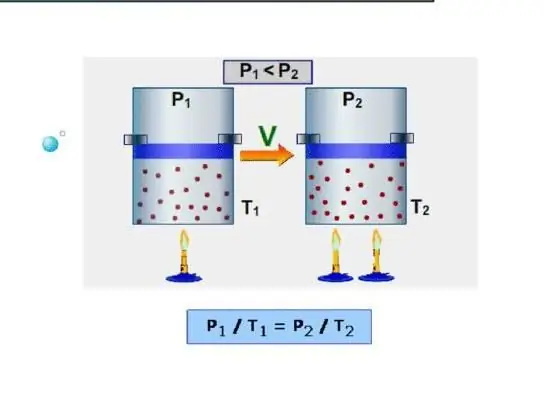
Cara termudah untuk suatu sistem adalah menentukan kapasitas panas isokhorik. Ini dipahami sebagai kapasitas panas pada volume konstan. Karena sistem tidak melakukan pekerjaan dalam kondisi seperti itu, semua energi dihabiskan untuk meningkatkan cadangan energi internal. Mari kita tunjukkan kapasitas panas isokhorik dengan simbol CV, maka kita dapat menulis:
dU=CVdT.
Yaitu, perubahan energi internalsistem berbanding lurus dengan perubahan suhunya. Jika kita bandingkan ekspresi ini dengan persamaan yang ditulis pada paragraf sebelumnya, maka kita sampai pada rumus untuk CV dalam gas ideal:
СV=z/2nR.
Nilai ini tidak nyaman untuk digunakan dalam praktik, karena tergantung pada jumlah zat dalam sistem. Oleh karena itu, konsep kapasitas panas isokhorik spesifik diperkenalkan, yaitu nilai yang dihitung per 1 mol gas atau per 1 kg. Mari kita tunjukkan nilai pertama dengan simbol CV, yang kedua - dengan simbol CV m. Untuk mereka, Anda dapat menulis rumus berikut:
CV=z/2R;
CVm=z/2R/M.
Di sini M adalah massa molar.
Isobarik adalah kapasitas panas sambil mempertahankan tekanan konstan dalam sistem. Contoh dari proses tersebut adalah ekspansi gas dalam silinder di bawah piston ketika dipanaskan. Berbeda dengan proses isokhorik, selama proses isobarik, panas yang disuplai ke sistem dihabiskan untuk meningkatkan energi internal dan untuk melakukan kerja mekanis, yaitu:
H=dU + PdV.
Entalpi proses isobarik adalah produk dari kapasitas panas isobarik dan perubahan suhu dalam sistem, yaitu:
H=CPdT.
Jika kita mempertimbangkan pemuaian pada tekanan konstan 1 mol gas, maka hukum pertama termodinamika akan ditulis sebagai:
CPdT=CV dT + RdT.
Suku terakhir diperoleh dari persamaanClapeyron-Mendeleev. Dari persamaan tersebut berikut hubungan antara kapasitas kalor isobarik dan isokhorik:
CP=CV + R.
Untuk gas ideal, kapasitas panas molar spesifik pada tekanan konstan selalu lebih besar dari karakteristik isokhorik yang sesuai dengan R=8, 314 J/(molK).
Derajat kebebasan molekul dan kapasitas panas
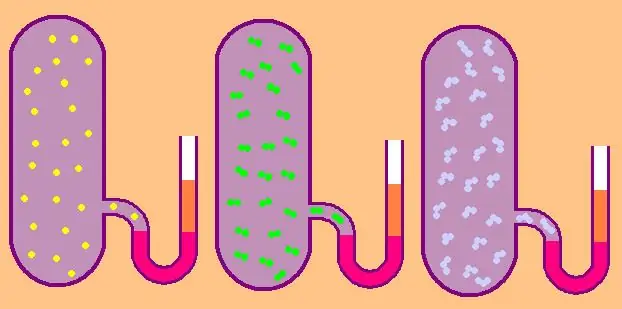
Mari kita tulis lagi rumus kapasitas kalor isokhorik molar spesifik:
CV=z/2R.
Dalam kasus gas monoatomik, nilai z=3, karena atom di ruang angkasa hanya dapat bergerak dalam tiga arah independen.
Jika kita berbicara tentang gas yang terdiri dari molekul diatomik, misalnya oksigen O2 atau hidrogen H2, maka, selain gerak translasi, molekul-molekul ini masih dapat berputar pada dua sumbu yang saling tegak lurus, yaitu z akan sama dengan 5.
Untuk molekul yang lebih kompleks, gunakan z=6. untuk menentukan CV






